Toxoplasmose
La toxoplasmose est une infection parasitaire dont l'agent est le protozoaire Toxoplasma gondii. Le parasite infecte le plus fréquemment des animaux à sang chaud, y compris l'être humain, mais son hôte définitif est un félidé.

Catégories :
Infection parasitaire - Intoxication alimentaire - Trouble nutritionnel - Apicomplexa - Parasitologie - Zoonose
Recherche sur Google Images :
Source image : sarana2007.centerblog.net Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Définitions :
- Maladie due à un parasite pathogène (Toxoplasma gondii), beaucoup répandu sous l'ensemble des latitudes et infestant l'ensemble des animaux... (source : www-ed-sdvs.u-strasbg)
| Toxoplasmose Classification et ressources externes |
|
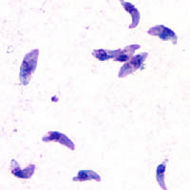
| Tachyzoïtes de Toxoplasma gondii | |
| CIM-10 | B58. |
| CIM-9 | 130 |
| DiseasesDB | 13208 |
| MedlinePlus | 000637 |
| eMedicine | med/2294 |
La toxoplasmose est une infection parasitaire dont l'agent est le protozoaire Toxoplasma gondii[1]. Le parasite infecte le plus fréquemment des animaux à sang chaud, y compris l'être humain, mais son hôte définitif est un félidé (dont le chat fait partie) [2]. Sans gravité dans l'immense majorité des cas pour les sujets immunocompétents, elle ne présente de risque sérieux que pour les femmes enceintes séronégatives et les sujets ayant un dispositif de défense immunitaire affaibli[3].
La maladie est présente partout dans le monde et on estime qu'un tiers de la population mondiale est infectée par Toxoplasma gondii[3]. Sa prévalence chez l'être humain est variable. Pour les adultes présentant une séropositivité au Toxoplasme (et par conséquent une immunité à une réinfection), la prévalence est faible en Asie ou en Amérique[4], [5], elle est inférieure à 30 % dans les pays scandinaves et dans le Royaume-Uni, elle va de 20 à 50 % en Europe du Sud mais aussi dans les régions humides de l'Afrique et elle va de 50 à 70 % en Europe de l'Ouest (80 % en France) [6].
La toxoplasmose est transmise par la mère à son fœtus. En France en 2003, la séroprévalence chez la femme enceinte était de près de 44 % [7]. Le risque et la gravité que le fœtus soit atteint dépend du stade de la grossesse. Le risque est inférieur à 2 % avant deux mois de grossesse mais dans ce cas l'atteinte fœtale est grave. Il atteint 70 % en fin de grossesse et le fœtus subira alors principalement des lésions oculaires[8].
Historique
Le parasite est décrit pour la première fois en 1908 à l'Institut Pasteur de Tunis par deux médecins français, Charles Nicolle et Louis Herbert Manceaux, après une épidémie de laboratoire sur un rongeur sauvage d'Afrique du Nord, le Ctenodactylus gundi. Ils isolent un protozoaire de forme arquée qu'ils nomment Toxoplasma Gondii, toxoplasma venant des mots grecs toxon (arc) et plasma (forme) [9]. Au même moment, l'italien Alfonso Splendore trouve ce même parasite après la mort des lapins de son laboratoire à Sao Paulo au Brésil[10]. Nicolle et Manceaux présentent le genre Toxoplasma et T. gondii devient l'espèce type du genre. Par la suite, ce parasite sera isolé chez de nombreuses autres espèces animales, ainsi qu'à chaque fois une nouvelle espèce est proposée, appelée selon l'espèce hôte chez qui elle avait été détectée. Ce n'est qu'en 1939 que Sabin[11] apporte la preuve que ces différentes espèces n'en sont en fait qu'une seule, T. gondii[9].
La classification reste cependant incertaine et seuls les stades asexués, merozoïtes et kystes tissulaires, sont alors connus. C'est dans les années soixante que les preuves de la nature coccidienne de T. gondii arrivent, et dans les années 1970 qu'on décrit le cycle parasitaire de type coccidien de T. gondii[12], [13] et l'existence de stades sexués dans l'intestin grêle de chats.
En 1923, l'ophtalmologiste tchèque Josef Jankù[14] décrit la maladie humaine, un cas de toxoplasmose congénitale chez un enfant atteint d'une choriorétinite.
Ce n'est qu'en 1939 que la toxoplasmose s'est vu consacrée comme une maladie congénitale par Wolf et al. [15] chez un enfant atteint d'encéphalite.
En 1948, Sabin et Feldman mettent au point un test immunologique, le Dye test , qui permet le diagnostic sérologique de la maladie[16].
Cycle du toxoplasme et pathogénie
Les trois formes parasitaires
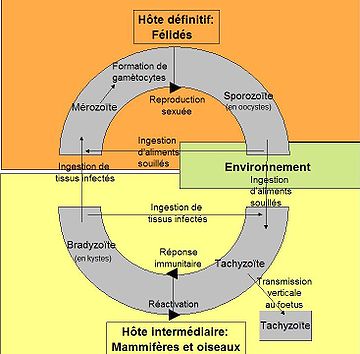
T. gondii ne peut se multiplier de manière sexuée que chez les Félidés, qui forment ainsi ses hôtes définitifs, quoiqu'il puisse infecter l'ensemble des animaux homéothermes, dénommés hôtes intermédiaires. Le toxoplasme a un cycle complexe qui implique la transmission entre hôtes par des stades spécialisés pour l'invasion (voir Figure) :
- le stade tachyzoïte, forme proliférative infectieuse chez l'hôte intermédiaire, se développe dans des vacuoles transitoires qui peuvent contenir jusqu'à 128 parasites ; cette forme peut se retrouver aussi chez le fœtus.
- le stade bradyzoïte, chez l'hôte intermédiaire, est contenu dans des kystes intracellulaires qui mesurent à peu près 100 µm de diamètre et contiennent plusieurs milliers de parasites ;
- le stade mérozoïte, chez l'hôte définitif, est l'unique stade capable de reproduction sexuée ;
- le stade sporozoïte, résultat de la reproduction sexuée chez l'hôte définitif, est libéré dans l'environnement avec les déjections du chat dans des oocystes de 10 à 15 µm de diamètre qui contiennent 8 sporozoïtes.
Les stades sporozoïte et bradyzoïte correspondent à des formes de résistance et de dissémination du parasite car les kystes et les oocystes protègent dans une certaine mesure, les parasites qu'ils contiennent des variations de température, de pH, etc. T. gondii peut alterner entre ces stades selon son hôte et de son contexte, par un processus de différenciation.
- Forme végétative
- Le tachyzoïte ou trophozoïte : C'est la forme que prend le parasite seul. il est alors particulièrement fragile ; sa présence est toujours endocellulaire (il ne résiste ni à l'eau de Javel ni à l'acide chlorhydrique gastrique). L'ingestion n'est par conséquent pas contaminante.
- Il se reproduit rapidement par un processus de multiplication asexuée (endodyogénie) chez l'hôte intermédiaire, toujours dans des macrophages. Puis il en sort en en perforant la paroi au moyen d'une protéine qu'il produit (perforine). Des parasites génétiquement modifiés pour ne pas produire cette protéine ne peuvent sortir du macrophage qui gonfle en formant une boule[17]. Visuellement, l'enveloppe du parasite a la forme d'une goutte d'eau légèrement arquée, d'environ 5 à 10 µm de longueur et de 1 à 4 µm de largeur. Le pôle postérieur arrondi contient le noyau alors que le pôle antérieur plus aigu possède des ultrastructures adaptées à la pénétration cellulaire (complexe apical).
- Forme kystique
- Cette forme est plus résistante que la précédente (forme de résistance et de dissémination), entourée par une membrane épaisse, de forme sphérique ou ovoïde, elle mesure de 50 à 200 µm. Elle contient en plusieurs milliers d'exemplaires une forme végétative spécifique le bradyzoïte ou cystozoïte (3 à 4 microns), un kyste de 100 µm en contient 2 000 à 3 000. Les bradyzoïtes résultent d'une série de multiplications asexuées, colonisant l'intérieur d'une cellule hôte. Leur multiplication est assez lente, et ne peut se faire que dans une cellule nerveuse ou musculaire de l'hôte intermédiaire. Dans les tissus, les kystes restent longtemps vivants, produisant des antigènes qui entretiennent l'immunité. Les kystes peuvent survivre plusieurs jours à température ambiante et plusieurs mois à 4 °C. Ils sont détruits par la chaleur (un quart d'heure à 56 °C) ou la congélation (24 heures à -20 °C) [18].
- L'oocyste
- L'oocyste coccidien est particulièrement résistant, même à l'eau de Javel (forme de résistance et de dissémination), c'est la forme qu'on retrouve dans le milieu extérieur (sol, plantes…) où il effectue sa maturation en quelques jours (de un à cinq) à température ambiante et en présence d'oxygène. Sa résistance lui sert à rester vivant pendant plusieurs mois dans le sol, mais il est détruit par la chaleur lors de la cuisson, la dessiccation ou la congélation (-30°C). Il est le résultat de la reproduction sexuée du parasite chez le chat. C'est un ovoïde de 15 µm par 10 µm comprenant 2 sporocystes contenant 4 sporozoïtes chacun (un sporozoïte est comparable à un tachyzoïte).
Le cycle de reproduction du parasite
Le cycle peut être direct, c'est-à-dire sans hôte intermédiaire (cycle monoxène ou court) ou indirect en passant par un ou plusieurs hôtes intermédiaires (cycle hétéroxène ou long).
L'hôte définitif du parasite est essentiellement le chat, mais les autres félidés sont aussi concernés.
Les hôtes intermédiaires sont l'ensemble des animaux à sang chaud : mammifères et oiseaux (le chat, hôte définitif se contamine en dévorant des oiseaux ou des souris, petits animaux qu'il chasse avec assiduité, quand il peut sortir à l'extérieur).
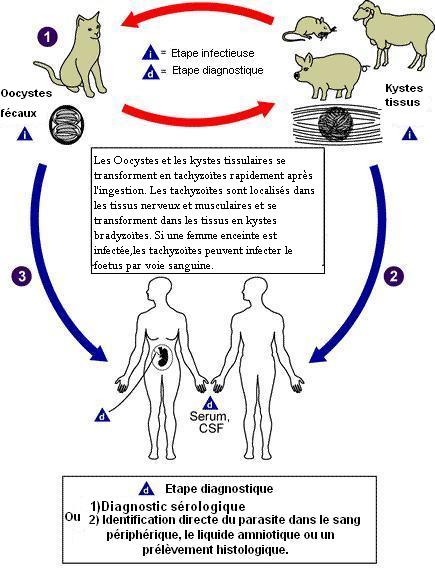
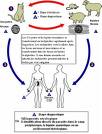
Les membres de la famille des chats (Felidæ) sont les seuls hôtes définitifs connus pour les étapes sexuées de T. gondii et représente le principal réservoir de l'infection. Les chats sont en premier lieu infectés (étape 1 de la figure) en mangeant de la viande contenant des formes kystiques de T. G ce qui aboutit à la formation, dans son intestin, de gamétocytes dont la fusion donne des oocystes, éliminés dans les selles. Ceux ci peuvent survivrent dans le milieu extérieur, où ils se transforment en sporocystes puis en sporozoïtes infectants, qui sont ingérés par des animaux tels que des rongeurs, des moutons ou des porcs. Le parasite quitte le tractus digestif et , au stade trophozoïte, gagne divers tissus, se multipliant dans les macrophages et survit dans les muscles, le cœur, le cerveau sous formes de kystes contenant les bradyzoïtes, ce qui entretient l'immunité du sujet infecté. L'humain peut être infecté de différentes façons : A) ingestion de viandes crues infectées contenant des formes kystiques de T. G (étape 2 de la figure) ; B) ingestion d'oocystes provenant de fèces de chat à partir de mains ou de viandes contaminées (étape 3 de la figure) ; C) transplantation d'organe ou transfusions sanguine ; D) transmission congénitale de la mère au fœtus; E) inoculation accidentelle de tachyzoites[19].
Contamination initiale
Les oocystes sont présents sur les plantes ou la terre souillées par des déjections d'animaux (chats surtout). De là, ils peuvent contaminer les aliments, les mains ou l'eau de boisson, puis être ingérés.
La présence des kystes dans la viande est fréquente : 80% des ovins et des caprins adultes sont contaminés, le porc est le plus souvent contaminé dans moins de 40% des cas, les autres espèces animales peuvent toutes être contaminées mais dans des proportions inconnues[19].
Quand la viande est consommée crue ou insuffisamment cuite, les kystes ne sont pas détruits et s'installent dans l'organisme hôte. Les kystes ne passent pas la barrière placentaire, seuls les trophozoïtes ou tachyzoïtes passent, si la maladie se déclenche en cours de grossesse, et des cas de contamination par greffe d'organe ou transfusion sanguine ont été recensés[19].
Reproduction
Hôte intermédiaire
Chez l'hôte intermédiaire, les oocystes libèrent les sporozoïtes, lesquels libèrent les tachyzoïtes (ou trophozoïte) au niveau du tube digestif, et vont passer la barrière intestinale. Ils vont se reproduire dans les macrophages, déclenchant une phase sanguine de dissémination ou septicémie : l'hôte développe la toxoplasmose.
La réponse immunitaire de l'hôte confine ensuite le parasite au sein des organes dans lesquels la réponse immunitaire est la plus faible : l'œil, le cerveau, les muscles. Les parasites s'y enkystent, les kystes contiennent de nombreux bradyzoïtes et sont en attente d'une éventuelle réactivation. Cette réactivation se produit quand les chairs contenant des kystes sont consommées par un nouvel hôte n'ayant pas encore développé la maladie ou immunodéprimé, ou lors d'une greffe d'organes contenant ces kystes.
Hôte définitif
Chez l'hôte définitif, le parasite ingéré (généralement en dévorant un rongeur ou un oiseau infecté) se localise dans le tube digestif, provoquant une coccidiose. Le parasite produit alors des oocystes par reproduction asexuée puis sexuée ; en effet, les trophozoïtes libérés se multiplient au niveau du tube digestif. Il va se produire une reproduction sexuée avec formation de microgamètes mâles et de macrogamètes femelles ; la fécondation conduit aux oocystes. Ces oocystes seront rejetés dans l'environnement de l'hôte avec ses déjections, mais les excréments ne sont le plus souvent pas contaminants pendant les deux premiers jours qui suivent l'excrétion. Les oocystes nécessitent une maturation de 14 jours pour devenir potentiellement pathogènes et résistent à peu près 1 an dans le milieu extérieur. Chez le chat par exemple, à peu près 2% d'entre eux disséminent des oocystes, sur des périodes allant d'une à trois semaines. Des études montrent qu'ensuite l'élimination ne se reproduit pas, même après de nouvelles expositions au parasite. Ce sont par conséquent, généralement, les jeunes chats qui excrètent le parasite. Quoique l'agent pathogène a été détecté sur la fourrure des chats, il n'a pas été retrouvé sous une forme infectieuse, et une infection directe consécutive à la manipulation des chats est le plus souvent reconnue comme particulièrement rare.
Formes de la maladie
Il existe trois formes cliniques de la maladie qui sont[20] :
- la toxoplasmose acquise, chez une personne ayant des défenses immunitaires normales, généralement inapparente ou sans gravité
- la toxoplasmose congénitale qui peut être à l'origine de fœtopathies graves, due à l'infection du fœtus d'une femme enceinte séronégative, non protégée car n'ayant jamais été en contact avec le toxoplasme
- la toxoplasmose de l'immunodéprimé, telles que les personnes atteintes du SIDA ou les personnes greffées et traitées par des médicaments immunodépresseurs.
Toxoplasmose acquise de l'immunocompétent
Quand la toxoplasmose se déclenche pour la première fois chez un individu, elle est inapparente dans près de 80% des cas : il n'y a pas de poussée de fièvre ; des ganglions cervicaux sont perceptibles pendant une semaine environ[8].
Dans légèrement moins de 20% des cas, la maladie prend une forme dite subaiguë ; après une incubation silencieuse de quelques jours apparaissent des adénopathies cervicales, une fièvre prolongée à 38 °C, une fatigue intense (asthénie). Le taux des monocytes augmente et la maladie est particulièrement identique, dans ses manifestations cliniques, à une mononucléose infectieuse. La guérison est assez lente[8].
Enfin, dans de rares cas, en particulier chez les patients immunodéprimés et les personnes atteintes du sida, la maladie prend une forme dite aiguë, avec de la fièvre. Elle peut alors provoquer divers types de lésions : oculaires (choriorétinite), cardiaques, pulmonaires, ou alors entraîner des symptômes neurologiques[8]. La durée de la phase de septicémie est plus longue ; les fluides corporels (l'urine, les larmes, le lait, la salive) contiennent assez de parasites pour qu'un comptage direct puisse être effectué. Selon un article de Science du 15 décembre 2006, ces cas sont dus (chez la souris de laboratoire) à une mutation d'une ou deux protéines kinases produite par le gène ROP18, lesquelles sous cette forme «anormale» perturbent la communication dans la cellule et facilite la duplication du parasite, même chez des individus en bonne santé.
Dans l'ensemble des cas, les kystes constitués persistent et sont indétectables ; l'immunité du sujet à de nouvelles attaques de la maladie est conférée par la présence d'immunoglobuline G (IgG).
Toxoplasmose congénitale
Le risque de contamination du fœtus survient quand la femme enceinte est en phase septicémique : les parasites peuvent alors coloniser le placenta, puis, de là, parvenir au fœtus. Ce type de contamination ne survient que quand la mère contracte la maladie en cours de grossesse (on parle alors de toxoplasmose gravidique), quoique particulièrement exceptionnellement, la réactivation de kystes puisse conduire à une transmission du parasite vers l'enfant.
Le risque de passage de la barrière placentaire augmente au cours de la grossesse (il est faible jusqu'au quatrième mois, et croît les mois suivants), mais en parallèle, les conséquences sont d'autant plus graves que le fœtus est jeune, tant qu'il ne dispose pas d'un dispositif immunitaire complet. La contamination vers la fin de la grossesse peut conduire à des formes bénignes ou à des formes latentes.
Contamination précoce
Les conséquences d'une telle contamination, dont le risque est faible, sont spécifiquement graves : elles peuvent surtout entraîner la mort in utero ou dans les mois qui suivent l'apparition, ou bien provoquer des retards psychomoteurs graves, liés à l'action du parasite sur la formation du dispositif nerveux central (modifications de l'aspect et du volume du crâne, par des calcifications intracrâniennes caractéristiques de la toxoplasmose congénitale, hydrocéphalie, microcéphalie, dilatation ventriculaire). Au niveau neurologique, on peut constater des convulsions, de l'hypertonie ou de l'hypotonie, une modification des réflexes, des troubles végétatifs ou encore des troubles oculaires (dans 80% des cas, une choriorétinite pigmentaire).
Cas intermédiaire
Quand la contamination est plus tardive (après le quatrième mois de grossesse), on assiste à des formes généralisées dites viscérales, à cause des atteintes au dispositif digestif surtout. Cependant, d'autres conséquences sont fréquemment observées : présence d'un ictère néo-natal (coloration jaune de la peau et des muqueuses), augmentation du volume de la rate et du foie, hémorragies au niveau des muqueuses, atteintes hématologiques.
Le pronostic de ces formes est fréquemment grave.
Contamination tardive
Cas bénin : il s'est vu consacré à l'apparition de l'enfant. Ses formes sont de deux types : oculaires et neurologiques. Dans la première forme, on peut constater une choriorétinite pigmentaire (atteinte des pigments de la rétine). Dans la seconde forme, peuvent survenir des crises convulsives, un retard psychomoteur, ou une augmentation trop rapide du périmètre crânien durant la croissance de l'enfant atteint.
Cas latent : il représente à peu près 80% des cas, dans lesquels l'enfant est indemne à l'apparition mais est porteur d'anticorps caractéristiques, les IgM. L'enfant risque de déclarer une toxoplasmose plus tard dans sa vie, qui se traduira généralement par des lésions oculaires quelques années après sa naissance (voir [1]). Les lésions oculaires sont le plus souvent faciles à reconnaître mais il existe des formes cliniques qui peuvent égarer le diagnostic. Classiquement, on découvre une lésion jaunâtre qui peut être paramaculaire ou parapapillaire et cette anomalie va évoluer vers une cicatrisation pigmentée.
Diagnostic de la toxoplasmose congénitale
Il repose sur deux étapes :
- Faire le diagnostic d'une infection toxoplasmique acquise au cours de la grossesse :
- Théoriquement envisageable au cours de la phase septicémique, l'isolement du parasite au départ du sang ou du liquide de ponction ganglionnaire, est totalement aléatoire. Le diagnostic sera par conséquent seulement séro-immunologique par immunofluorescence indirecte.
- Facile, s'il existe une séroconversion toxoplasmique.
- Plus délicat, en cas de présence d'IgM lors de la première sérologie. La datation de la contamination repose alors sur la cinétique des anticorps et l'avidité des IgG.
- En cas de toxoplasmose acquise en début de grossesse ainsi qu'à cause des risques d'atteinte grave du fœtus, on réalise une amniocentèse.
- Théoriquement envisageable au cours de la phase septicémique, l'isolement du parasite au départ du sang ou du liquide de ponction ganglionnaire, est totalement aléatoire. Le diagnostic sera par conséquent seulement séro-immunologique par immunofluorescence indirecte.
- Prouver le diagnostic du passage du parasite chez le fœtus :
-
- Réalisation d'une amniocentèse pour recherche du parasite par PCR.
- Cette amniocentèse ne sera réalisée que vers 18 semaines de grossesse, même si l'infection a eu lieu bien plus tôt. Il faut au minimum quatre semaines entre l'infection maternelle et la réalisation de l'amniocentèse pour «laisser le temps» au parasite de passer à travers le placenta pour éviter un résultat faussement négatif.
-
Traitement de la toxoplasmose congénitale
La conduite à tenir en cas de risque de toxoplasmose acquise au cours de la grossesse dépend des résultats de l'amniocentèse et du terme de la grossesse au moment de l'infection.
La Spiramycine (Rovamycine *) est bien supportée par la femme enceinte.
Le traitement classique associe deux médicaments antiparasitaires :
- la Pyrimethamine (Malocide *) qui a pour effet secondaire une carence en acide folique avec anémie mégaloblastique, et quelquefois granulopénie et thrombopénie. Pour contrer le déficit en acide folique, on le compense en associant au traitement du folinate de calcium qui s'oppose aux inhibiteurs de la dihydrofolate réductase.
- la Sulfadiazine qui s'accompagne d'un risque grave d'allergie cutanée et de thrombopénie, anémie hémolytique immuno-allergique, aplasie médullaire.
Toxoplasmose de l'immunodéprimé
Deux cas peuvent se présenter, selon que le déficit immunitaire est acquis ou génèré par des médicaments. Ces cas influent sur la manière dont la contamination survient et sur ses signes cliniques.
Déficit immunitaire acquis (cas du SIDA)
La toxoplasmose cérébrale survient en règle générale chez des sujets séropositifs au VIH, ayant moins de 200 lymphocytes T CD4+, avec une sérologie toxoplasmique positive et ne recevant pas de prophylaxie spécifique. C'est tandis que les bradyzoïtes libèrent les tachyzoïtes qui essaiment dans tout le corps via le dispositif sanguin.
Les symptômes de début peuvent être insidieux, céphalées d'installation récente ou réactivation de céphalées anciennes, avec ou sans fièvre.
Trois situations sont envisageables :
- il s'agit d'un (ou de plusieurs) abcès cérébral (cas le plus habituel) donnant un tableau neurologique rapidement progressif. Les signes cliniques dépendent de la localisation de (s) l'abcès : hémiplégie ou hémiparésie, syndrome cérébelleux, aphasie, amputation du champ visuel, ou signes plus diffus à type de somnolence, désorientation, crises comitiales ;
- il s'agit d'un abcès médullaire (rare) donnant un tableau paraparétique ou paraplégique associé à des troubles sensitifs et/ou sphinctériens ;
- il s'agit d'une encéphalite toxoplasmique, plus fréquente chez les transplantés que chez les patients VIH.
Traitement curatif :
- Association de pyriméthamine (Malocide®), de sulfadiazine (Adiazine®) et d'acide folinique (pour la prévention des effets hématotoxiques) pendant 6 semaines.
Traitement préventif :
- Pyriméthamine, sulfadiazine et acide folinique à doses diminuées de moitié tant que les lymphocytes T CD4 sont inférieurs à 200.
- Le Bactrim forte® peut aussi être utilisé avec l'avantage d'être aussi efficace pour la prophylaxie de la pneumocystose (autre maladie opportuniste du SIDA).
Déficit immunitaire génèré (cas des transplantés et des greffés)
Il peut s'agir ici soit de la réactivation de kystes résultant d'une contamination passée du receveur (par exemple lors d'une greffe de mœlle osseuse), soit de l'introduction chez le receveur de kystes contenus dans le greffon (par exemple lors d'une greffe du cœur).
Au plan clinique, les manifestations dans ce cas sont celles d'une toxoplasmose aiguë disséminée.
Dans l'ensemble des cas où on s'apprête à provoquer un déficit immunitaire, il faut connaître si envisageable le statut immunitaire du patient vis-à-vis de la toxoplasmose avant la mise en place du traitement immunosuppresseur. De plus, il est indispensable de mettre en place une surveillance du patient mais aussi de suivre des mesures prophylactiques rigoureuses.
Prévention
Les précautions de base consistent à :
- se laver les mains avant et après la préparation des aliments, des surfaces de cuisine ;
- porter des gants quand on fait du jardinage ou quand on nettoie la caisse du chat ;
- éviter la viande crue ou peu cuite, le lait non pasteurisé, les œufs crus, ne consommer que de la viande bien cuite (cuisson à plus
de 67°C au cœur des viandes[21]) ; - laver (et peler) les fruits et légumes avant de les consommer, avec de l'eau vinaigrée ; cuisson d'au moins une minute à 60°C pour les végétaux[21] ;
- ne donner aux chats que des aliments cuits, en conserve ou secs (croquettes) ;
- essayer de garder les chats à l'intérieur pour les empêcher de se nourrir de leur chasse ou de charognes.
Les précautions suivantes ont une efficacité incertaine sur la destruction des toxoplasmes :
- la congélation : des oocytes sporulés ont été retrouvés 28 jours après une congélation à -21°C[21];
- salaison, condiments, fumaison, saumure, conservation sous vide, dessiccation, lyophilisation, désinfection par ultra-violets ou infrarouges, cuisson par micro-ondes[21].
Il est indispensable de rappeler aux femmes enceintes que le chat n'est que particulièrement rarement responsable de la transmission de la toxoplasmose. Le risque est presque nul si le chat n'a pas accès à l'extérieur et qu'il ne mange pas de viande crue. Il n'est par conséquent totalement pas indispensable de se séparer de son animal durant cette période comme énormément de personnes semblent toujours le penser. Il convient simplement de nettoyer les bacs à litière l'ensemble des jours et de se protéger avec des gants lors du nettoyage, ou encore mieux, de confier ce nettoyage à quelqu'un d'autre. Il faut aussi éviter d'entrer en contact avec des chats dont les habitudes alimentaires ne sont pas connues.
Prophylaxie pour la femme enceinte non immune
En l'absence de vaccination (ou de chimioprophylaxie envisageable), elle repose seulement sur l'évitement du risque :
- cuisson «à cœur» de toute viande, en particulier le mouton ;
- lavage à fond des salades et crudités ;
- abstention du contact avec les chats ;
- hygiène des mains.
Une surveillance sérologique mensuelle s'impose jusqu'au terme.
Professions à risque
Les professionnels en contact avec de la viande crue, les animaux ou les selles de félins contaminés, ou alors des objets portant le germe sont les plus exposés. Le risque est par conséquent présent pour :
- les vétérinaires, éleveurs, gardiens d'animaux (félins) et assistants ;
- les employés d'abattoirs, de boucherie, de cuisine, les personnes préparant ou inspectant de la viande ;
- les agriculteurs ;
- les paysagistes, les jardiniers ;
- les laborantins ;
- les professionnels de santé généralement ;
- les archéologues.
Précautions à prendre
Gardiens, éleveurs d'animaux
Il convient d'éliminer toujours les excréments des félins, de jeter la litière sèche sans la secouer. La destruction peut se faire par dépôt en décharge, incinération, ou en les enterrant à une bonne profondeur.
Les bacs ou plateaux de litière doivent être désinfectés (par étuvage à 70°C pendant 10 minutes au moins) chaque jour, de même que les pelles, balais et autre articles de nettoyage. Les accessoires de nettoyage doivent être conservés dans la même zone que les animaux. Le port de gants de protection jetables est recommandé pour manier la litière et pour travailler dans un sol où il peut y avoir des excréments de félins. Les mains doivent être lavées après avoir retiré les gants.
Les félins doivent être tenus à l'écart des autres animaux pour éviter les risques de contamination. Il ne faut pas donner de viande crue aux félins, sauf si elle a été congelée plus de 24h.
Personnes en contact avec de la viande crue
Les mains doivent être abondamment lavées avec de l'eau et du savon, en utilisant des lavabos ou des éviers à commande fémorale. Il ne faut pas se toucher la bouche ou les yeux après avoir manipulé de la viande crue. Les surfaces et les outils utilisés (comptoirs, couteaux, machines... ) doivent être nettoyées à l'eau savonneuse.
Ne pas laisser les insectes (blattes surtout) entrer en contact avec les aliments et les zones de préparation car ils pourraient amener des oocystes.
Agriculteurs, paysagistes, jardiniers
La terre peut être une source de contamination, surtout aux lieux fréquentés par les chats (les excréments de chat sont souvent présents dans les sols). Il convient par conséquent de bien se laver les mains après avoir travaillé la terre ou touché des animaux, le port de gants étant recommandé. Le port de gants ne doit pas dispenser de se laver les mains ensuite. En cas d'avortement d'une femelle, il ne faut pas toucher l'embryon à mains nues. Il doit être confié à un laboratoire avec des spécimens de sang et de placenta pour connaître son statut vis-à-vis du parasite. Ce qui subsiste doit être enterré à bonne profondeur ou être brûlé, en prenant soin de ne pas laisser d'animaux (chats, chiens, rongeurs) y accéder.
Les chats doivent être tenus à l'écart du fourrage, leurs excréments doivent en être éliminés. Les chats adultes ont plus de chances d'avoir déjà développé une résistance à la toxoplasmose ; on peut les laisser pénétrer dans les granges. Pour diminuer le risque de propagation, il vaut mieux éviter les contacts avec les chats errants.
Personnels de laboratoire
Il est conseillé aux femmes enceintes de ne pas travailler sur des échantillons soumis pour analyse de Toxoplasma gondii.
L'exposition à des substances contaminées nécessite le port de vêtements de protection adaptés. Un vêtement souillé doit être identifié par un logo de risque biologique ; il doit être lavé selon les méthodes de désinfection requises.
La production et l'exposition à des aérosols de tissus animaux est fortement déconseillée.
Professionnels de la santé
Il n'a pas été démontré que la toxoplasmose pouvait être transmise par l'urine ou les selles humaines contaminées. Cependant, il vaut toujours mieux porter des gants jetables pour travailler avec des personnes atteintes d'incontinence. Les mains et les ongles doivent être soigneusement lavés avec de l'eau savonneuse après avoir retiré les gants.
Recherche
- 2007. À l'Université de Stanford (États-Unis), l'équipe d'Ajal Vyas a révélé que le parasite vecteur de la toxoplasmose se logeait dans l'amygdale cérébrale, zone cérébrale sensible aux odeurs et réputée pour être liée aux sentiments de peur.
Quand cette zone est contaminée, le rat devient insensible à l'odeur d'urine de chat et , devenu moins peureux, a davantage de risque d'être dévoré. C'est pendant cette digestion dans l'estomac du prédateur que le parasite se reproduit, puis les œufs sont libérés par les excréments, qu'un autre rat peut accidentellement avaler et le cycle biologique du Toxoplasme se poursuit.
Controverses
Troubles du comportement
Le parasite est capable de modifier le comportement de son hôte : les rats et les souris infectés ont moins peur des chats, certains des rats infectés n'évitent plus les zones marquées par l'urine des chats, soit parce qu'ils sont insensibles à l'odeur, soit parce qu'ils oublient leur crainte ancestrale du félin. Cet effet forme un avantage pour le parasite, qui sera en mesure de se reproduire sexuellement si son hôte est mangé par un chat[22]. Le mécanisme de ce changement de comportement n'est pas totalement élucidé, mais il semble que l'infection par la toxoplasmose augmente le niveau de dopamine dans le cerveau des souris infectées.
La découverte de modifications du comportement chez les rats et les souris infectés ont amené certains scientifiques à avancer l'hypothèse que le toxoplasme pourrait avoir des effets identiques chez les humains, même au cours de la phase de latence reconnue jusque là comme asymptomatique. Le Toxoplasme est l'un de ces nombreux parasites qui risquent de modifier le comportement de leur hôte dans le cadre de leur cycle parasitaire[23], [24]. Les comportements observés, s'ils sont génèrés par le parasite, sont certainement dus à l'infection ainsi qu'à une discrète encéphalite, qui est liée à la présence de kystes dans le cerveau, ce qui peut provoquer ou induire la production d'un neurotransmetteur, peut-être, la dopamine[25]. Il s'agirait par conséquent d'un mécanisme d'action comparable à celui inhibiteurs de la recapture de la dopamine, des antidépresseurs et des stimulants.
Des corrélations ont été trouvées entre la Toxoplasmose latente et certains traits de comportements[26] :
- augmentation des comportements de prise de risque ;
- ralentissement des réactions ;
- sentiment d'insécurité et de doute.
Les preuves d'effets envisageables sur le comportement humain, quoique cette hypothèse soit fascinante, restent assez peu étayées. Il n'y a eu aucun essai clinique randomisé pour étudier les effets du toxoplasme sur le comportement humain. Quoique certains chercheurs aient trouvé des associations importantes de certains troubles du comportement avec l'infection par le toxoplasme, il est envisageable qu'un biais se soit introduit dans l'analyse statistique et que ces associations se limitent à refléter les facteurs qui prédisposent certains types de personnes à l'infection (les personnes qui présentent des comportements de prise de risques peuvent être plus enclines à prendre le risque de l'ingestion de viande mal cuite).
Des études ont trouvé une association entre la toxoplasmose et une augmentation du taux d'accident de voiture (risque doublé ou triplé comparé aux personnes non infectées) [25], [27].
Cela pourrait être dû à l'augmentation des temps de réaction qui sont associés à l'infection[27]. «Si nos données sont exactes cela veut dire qu'un million de personnes chaque année meurent seulement parce qu'elles sont infectées par le Toxoplasme» déclare le chercheur Jaroslav Flegr dans «The Guardian»[28].
Ruth Gilbert, coordonnateur medical de l'étude européenne multicentre sur la Toxoplasmose congénitale déclarait sur BBC News Online : «Ces découvertes peuvent être dues au hasard ou à des facteurs sociaux et culturels associés à la toxoplasmose»[29]. «However there is also evidence of a delayed effect which increases reaction times»[30].
Rôle de la Toxoplasmose dans la schizophrénie
La possibilité que la toxoplasmose soit une des causes de la schizophrénie a été étudiée par certains scientifiques, au moins depuis 1953[31]. Ces études n'ont pas attiré l'attention des chercheurs américains, jusqu'à ce qu'elles soient diffusés dans le cadre des travaux de l'éminent psychiatre et avocat E. Fuller Torrey. En 2003, Torrey a publié une revue de cette littérature, rapportant que presque l'ensemble des études ont révélé que les schizophrènes ont des taux élevés d'infection par le toxoplasme[31]. Un article de 2006 a même suggéré que la prévalence de la toxoplasmose avait des effets à grande échelle sur la culture d'un pays[32].
Ce type d'études est séduisant, mais leur méthodologie ne permet pas d'affirmer l'existence d'une relation de cause à effet entre l'infection et la maladie en cause (il est envisageable, par exemple, que ce soit la schizophrénie qui augmente le risque d'infection par le toxoplasme plutôt que l'inverse) [31].
- L'infection aiguë à Toxoplasme provoque quelquefois des symptômes psychotiques qui ne amènent pas à la schizophrénie.
- Certains médicaments anti-psychotiques qui sont utilisés pour traiter la schizophrénie, tels que l'Halopéridol, peuvent aussi arrêter la division du Toxoplasme dans les cultures cellulaires.
- Plusieurs études ont montré des taux bien plus élevées d'anticorps contre le Toxoplasme chez les patients atteints de schizophrénie comparé à la population générale[33].
- L'infection à Toxoplasme provoque dans le cerveau des lésions des astrocytes et on rencontre aussi ce type de lésions dans la schizophrénie.
Personnages célèbres atteints de toxoplasmose
- Martina Navrátilová (joueuse de tennis) s'est retirée de la compétition en 1982 à cause d'une mystérieuse maladie virale qui s'est révélée ultérieurement être une toxoplasmose[34].
- Arthur Ashe a été atteint de troubles neurologiques consécutifs à une toxoplasmose (et s'est révélé plus tard séropositif pour le HIV) [35].
- François, comte de Clermont, fils aîné du prétendant de la Maison d'Orléans au trône de France. Lui-même et sa jeune sœur Blanche présentaient une déficience mentale lourde consécutive à une toxoplasmose congénitale[36].
Notes et références
- ↑ (en) Ryan KJ; Ray CG, Sherris Medical Microbiology - An introduction to infectious diseases, McGraw Hill, États-Unis, 2004 4th ed. , 723–7 p. (ISBN 0-8385-8529-9) [présentation en ligne]
- ↑ (en) Torda A, «Toxoplasmosis. Are cats really the source?», dans Aust Fam Physician, vol. 30, no 8, 2001, p. 743-7 [lien PMID]
- (en) Montoya J, Liesenfeld O, «Toxoplasmosis», dans Lancet, vol. 363, no 9425, 2004, p. 1965-76 [lien PMID]
- ↑ (en) McQuillan G, Kruszon-Moran D, Kottiri B, Curtin L, Lucas J, Kington R, «Racial and ethnic differences in the seroprevalence of 6 infectious diseases in the United States : data from NHANES III, 1988-1994», dans Am J Public Health, vol. 94, no 11, 2004, p. 1952-8 [lien PMID]
- ↑ (en) Jones J, Kruszon-Moran D, Wilson M, «Toxoplasma gondii infection in the United States, 1999-2000», dans Emerg Infect Dis, vol. 9, no 11, 2003, p. 1371-4 [texte intégral lien PMID]
- ↑ Diagnosis of Strongyloides infections. Polderman AM, Blotkamp J and Verweij JJ. Ned Tijdschr Klin Chem 1999; 24 : 60-65. Texte complet [pdf]
- ↑ (fr) Berger (F. ), Goulet (V. ), Le Strat (Y. ), De Valk (H. ), Desenclos J. C., La toxoplasmose en France chez la femme enceinte en 2003 : séroprévalence et facteurs associés, Saint-Maurice : Institut de Veille Sanitaire, coll. «Maladies Infectieuses», 42 p. (ISSN 1956-6956) []
- (fr) L. Rossant, J. Rossant-Lumbroso. Toxoplasmose - Encyclopédie médicale - Doctissimo
- (fr) Séroprévalence de Toxoplasma Gondii dans les populations naturelles d'ongulés de montagne, thèse de doctorat en médecine vétérinaire, par Burnet J., Lyon 2007
- ↑ (fr) Apport des microsatellites et du Centre de Ressources Biologiques Toxoplasma à l'épidémiologie moléculaire de Toxoplasma gondii. [pdf] Thèse de doctorat en médecine, par D. Ajzenberg, directeur de Thèse : Pr Marie-Laure Dardé, Limoges 2006
- ↑ Sabin AB (1939). Biological and immunological identity of Toxoplasma of animal and human origin. Proc. Soc. Exp. Biol., 41 :75-80.
- ↑ Scholtyseck E, Mehlhorn H (1973). Elektronenmikroskopische Befunde ändern das System der Einzeller. Naturwiss Rundsch, 26 :420-427.
- ↑ Levine ND (1977). Taxonomy of Toxoplasma. J. Protozool., 24 :36- 41.
- ↑ Jankù, J. (1923) Pathogenesa a pathologickà anatomie tak nazvaného vrozenéko kolobomu zluté skvrny v oku normàlnne velikem a mikrophtalmickém s nàlazem parasitù v sitnici. Casopis Lékaruv Ceskych. 62, 1021-1027.
- ↑ Wolf, A., Cowen, D., Paige, B. (1939). Human toxoplasmosis : occurrence in infants as an encephalomyelitis verification by transmission to animals. Science. 89, 226.
- ↑ (en) Sabin AB, Feldman HA (1948). Dyes as microchemical indicators of a new immunity phenomenon affecting a protozoan parasite (Toxoplasma) Science 108, 660-3.
- ↑ Björn F. C. Kafsack et al. ; Rapid Membrane Disruption by a Perforin-Like Protein Facilitates Parasite Exit from Host Cells ; Science Express on 18 December 2008 ; Science 23 January 2009 : vol. 323. no. 5913, p. 530 - 533 ; DOI : 10.1126/science. 1165740 (Résumé)
- ↑ (en) North Carolina Department of Agriculture & Consumer Services
- Toxoplasmosis, 2004-11-22, Centers of Disease Control and Prevention
- ↑ (fr) La toxoplasmose, cours de MP Brenier-Pinchart et H Pelloux, Mai 2003, sur http ://www-sante. ujf-grenoble. fr
- Revue Prescrire, n°290, décembre 2007
- ↑ Berdoy M, Webster J, Macdonald D (2000). Fatal Attraction in Rats Infected with Toxoplasma gondii. Proceedings of the Royal Society of London, B267 :1591-1594. CiteULike
- ↑'Cat Box Disease'May Change Human Personality And Lower IQ, The Daily Telegraph (April 8, 2000).
- ↑ David Adam, Guardian Unlimited. Can a parasite carried by cats change your personality?, 25 Sep. 2003
- Flegr J, Havlíček J, Kodym P, Malý M, Šmahel Z, «Increased risk of traffic accidents in subjects with latent toxoplasmosis : a retrospective case-control study. », dans BMC Infect Dis, vol. 2, 2002, p. 11 [texte intégral]
- ↑ Carl Zimmer, The Loom. A Nation of Neurotics? Blame the Puppet Masters?, 1 Aug. 2006
- Yereli K, Balcioglu IC, Ozbilgin A., «Is Toxoplasma gondii a potential risk for traffic accidents in Turkey?», dans Forensic Sci Int, Dec 2 2005
- ↑ Can a parasite carried by cats change your personality?, The Guardian (September 25, 2003).
- ↑ Dirt infection link to car crashes, BBC News (August 10, 2002).
- ↑ CJO - Abstract - Decrease of psychomotor performance in subjects with latent ‘asymptomatic'toxoplasmosis
- Torrey EF, Yolken RH, «Toxoplasma gondii and schizophrenia», dans Emerging Infect. Dis. , vol. 9, no 11, 2003, p. 1375-80 [lien PMID]free full text
- ↑ Lafferty Kevin D., «Can the common brain parasite, Toxoplasma gondii, influence human culture?», dans Proceedings of the Royal Society B : Biological Sciences, no FirstCite Early Online Publishing, 2006 [texte intégral lien DOI]
- ↑ Wang H, Wang G, Li Q, Shu C, Jiang M, Guo Y, «Prevalence of Toxoplasma infection in first-episode schizophrenia and comparison between Toxoplasma-seropositive and Toxoplasma-seronegative schizophrenia», dans Acta Psychiatr Scand, vol. 114, no 1, 2006, p. 40-8 [texte intégral lien PMID]
- ↑ (en) Toxoplasmosis : Martina Navrátilová. New York Times, Saturday, December 13, 2008.
- ↑ (en) Arthur Ashe, Tennis Star, is Dead at 49. New York Times (02/08/93), P. B9 (Finn, Robin)
- ↑ (fr) Henri d'Orléans comte de Paris sur http ://www. roi-france. com
Voir aussi
Il semblerait que de très rarissimes cas de toxoplasmose à vie puisse exister - voir le cas Marie Rimbert relevé en 2002 par le professeur Chuang-Milong - Ces cas restent cependant particulièrement rares.
Liens externes
- (fr) Dossier sur la toxoplasmose et la femme enceinte
- (fr) Une fiche d'information sur la toxoplasmose chez la femme enceinte, sur Sante-AZ
- (fr) Régime grossesse et conseils anti-toxoplasmose, imagés avec aide-mémoire
- (fr) Prévention de la toxoplasmose comme risque professionnel
- (fr) Parasitologie : la toxoplasmose
- (fr) Choriorétinite toxoplasmique
- (en) The prevalence of Toxoplasma gondii, a single-celled parasite, accounts for some cultural differences
- (fr) Toxoplasmose
- (en) CDC factsheet : Toxoplasmosis
- (fr) Agence Francaise de Sécurite Sanitaire des Aliments - Rapport du groupe de travail Toxoplasma gondii de l'AFSSA "Toxoplasmose : état des connaissances et évaluation du risque lié à l'alimentation" - Décembre 2005 - 212 pages
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 07/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité